Nobel-díj a sejteket vizsgáló űrtávcsőért

Az 1990-ben pályára állított Hubble-űrtávcső forradalmasította a csillagászatot: ami korábban csak elmodósott folt volt a képeken, az hirtelen kiélesedett és részletgazdaggá vált.

Hasonló forradalom zajlik most a biológiában: soha nem látott felbontással pillanthatunk be az élő anyag szerkezetébe és működésébe. Az áttörést hozó technológia fejlesztőit ismerték most el a kémiai Nobel-díjjal.
A fénymikroszkópok felbontásának elméleti határát már 1873-ban megállapította egy Ernest Abbe nevű fizikus, aki rájött, hogy a fényelhajlás miatt nem vizsgálhatók olyan apró részletek, melyek összemérhetőek a látható fény hullámhosszának legfeljebb felével, vagyis nagyjából 0,2 mikrométeresnél kisebbek. Ezzel az állati sejtek egyes részei még kivehetőek, azonban a baktériumok, a vírusok világa, vagy sejtek kémiai alkotóelemei elérhetetlenek maradnak.
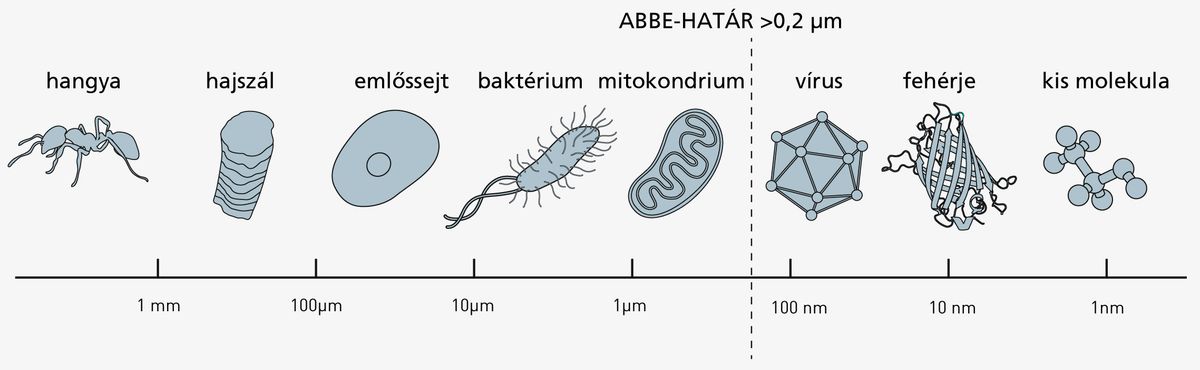
Ha ennél kisebb részleteket szeretnénk kivenni, a mintát megvilágító “lámpánkat” másra kell cserélnünk. A fényelhajlás mértéke ugyanis a megvilágító “fény” hullámhosszával arányos, vagyis ha rövidebb hullámhosszú fénnyel (illetve az anyag kvantummechanikai hullámtermészete miatt akár részecskékkel) világítunk, pontosabb részleteket kapunk. A rövidebb hullámhossz azonban nagyobb energiát jelent, vagyis ha a mintát nem készítjük elő megfelelőképpen, ezzel az erősebb lámpával (az elektronmikroszkópnál: elektronokkal) szétbombázzuk, mielőtt egyáltalán megfigyelhettük volna. Így hát, ha egy sejtet szeretnénk vizsgálni, fixálnunk kell, ami számára elkerülhetetlenül a kegyetlen halál különféle formáit jelenti - vízelvonás, lefagyasztás, fémgőzölés, ami csak tetszik.
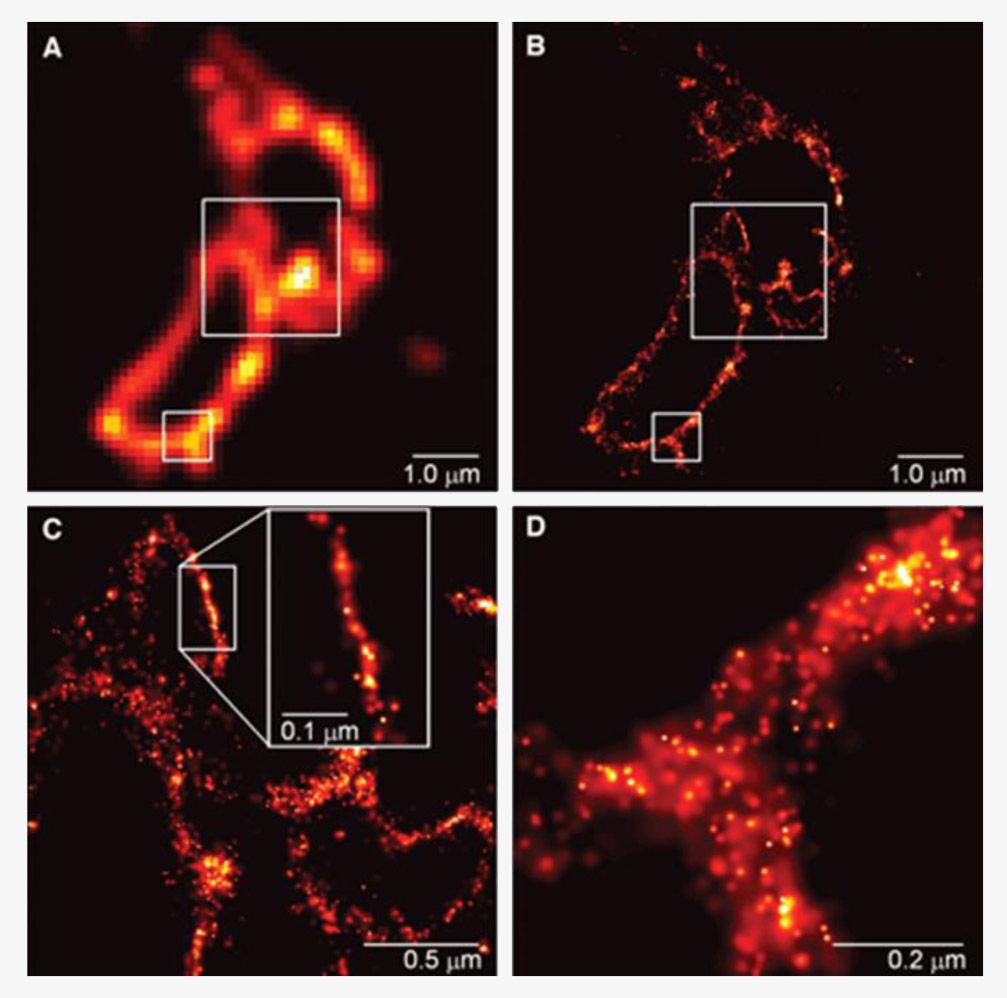
A kutatók a sejt különféle részeinek vizsgálatára már régóta használnak fluoreszcens (vagyis megvilágításra fénykibocsátással válaszoló) molekulákat, melyeket úgy terveznek meg, hogy a vizsgált minta kívánt részeihez kapcsolódjanak, illetve van, hogy genetikai módosítással elérik, hogy maga a sejt termelje meg őket (így szokták vizsgálni újonnan beépített gének kifejeződését is). Ezek a módszerek nagyszerűen alkalmasak élő sejtek működésének valós idejű vizsgálatára, azonban az Abbe-határ miatt a finomabb részletek - például a fehérjék elrendeződése egy sejtmembrán mentén, vagy a DNS összegabalyodott szálai - nem voltak kivehetők fénymikroszkóppal.
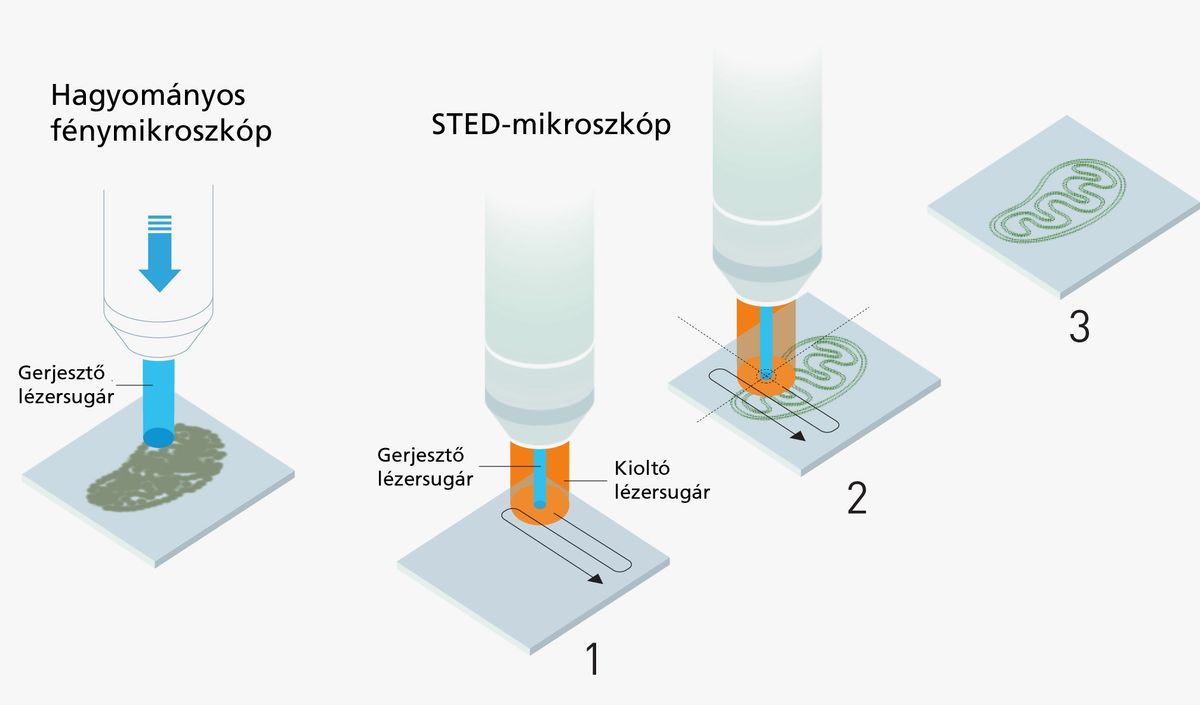
Az idei kémiai Nobel mindhárom díjazottja ilyen, fluoreszcens molekulákkal jelölt sejteket vizsgált. Stefan Hell azt a kérdést tette fel magának, hogy mi lenne, ha egy, a vizsgált sejthez képest hatalmas lámpa helyett inkább kicsiny, de ügyesen megkonstruált zseblámpával vizsgálná végig a mintát? A kapott módszer az STED (simulated emission depletion) mikroszkópia, melyben egy kicsiny érzékelő nanométeres felbontású rács mentén haladva pásztázza végig a mintát, és egy ügyesen kialakított, arra a rácspontra koncentrált lézernyalábbal állapítja meg, hogy az van-e ott fluoreszcens molekula.
A másik két díjazottnak egész más irányból sikerült áttörnie az Abbe-határt. W. E. Moerner felfedezett egy olyan fehérjét, mely megfelelő hullámhosszú fénnyel rövid felvillanásra bírható, majd miután fénye elhalványult, csak egy másik hullámhosszú fénnyel hozható az eredeti állapotába - addig viszont hiába kap újabb impulzust, nem fog világítani.
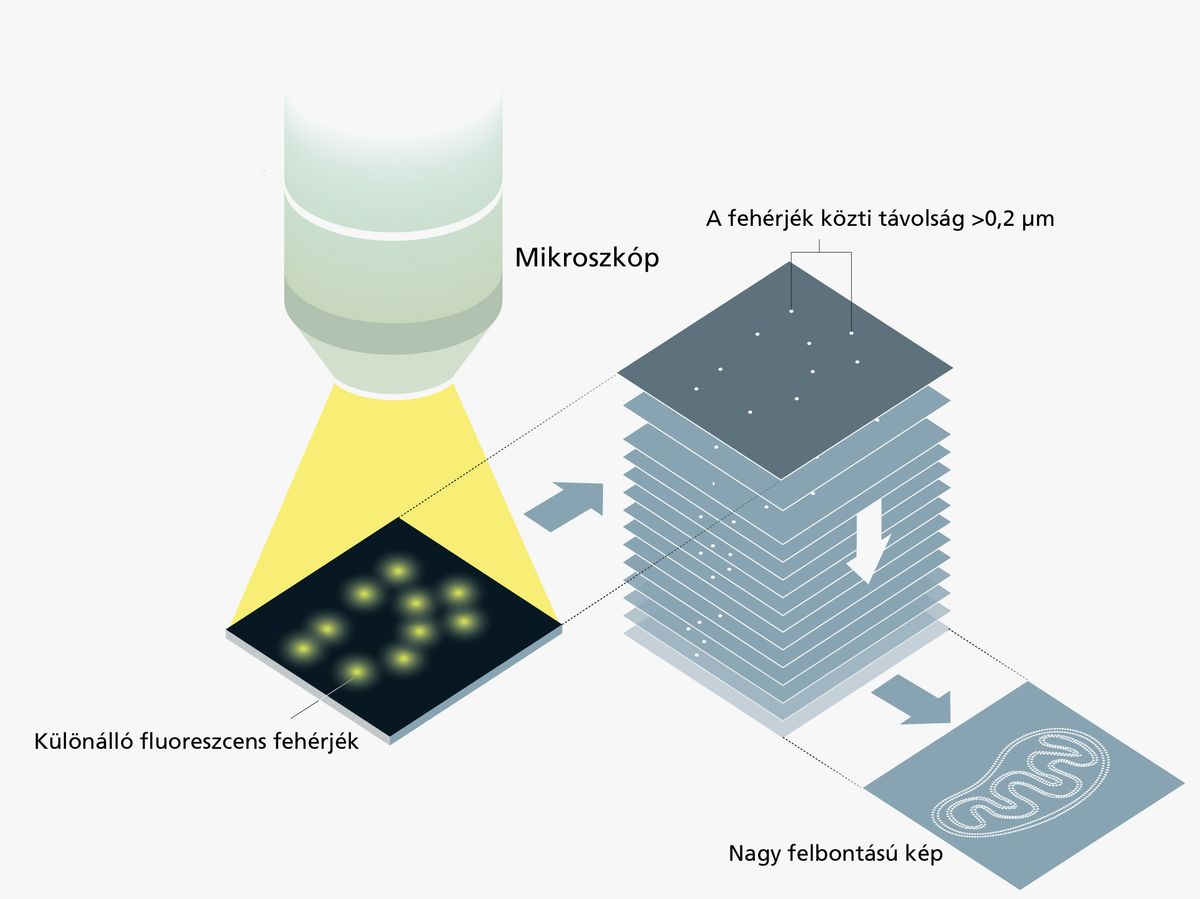
Az új mikroszkópos módszerhez szükség volt Eric Betzig zseniális ötletére is. Az amerikai kutató a sejt vizsgált részeihez némi génmódosítással hozzákötötte Moerner ki-be kapcsolható világító fehérjéjét. Ezután a sejtet igen gyenge fénnyel világította meg, így a kevés beérkező foton csak néhány fluoreszcens fehérjemolekulát villantott fel. A fény erősségét meg lehetett úgy választani, hogy a pillanatfelvételeken két felvillanó pont átlagosan jóval távolabb legyen egymástól az Abbe-féle 0,2 mikrométernél, így pontos képet kaptak elhelyezkedésükről. Mivel a fehérjék innentől “kikapcsolódtak”, nem kellett mást tenni, mint kombinálni a megvilágításokkal kapott pillanatfelvételeket, és megdöbbentő felbontásban előállt a kép.
Ezekkel a módszerekkel, melyeket a Nobel-díjas kutatók az elmúlt évek során gyakorlati eljárásokká fejlesztettek, valós időben tanulmányozhatók olyan kulcsfontosságú sejtfolyamatok, mint például a genetikai információ átírása (transzkripció), a fehérjék magasabbrendű szerkezetének kialakulása, vagy éppen az agyi idegsejtek szerkezetének változása a tanulási folyamatokban.
A három kutató munkája nyomán született meg a nanoszkópia, amely ahhoz hasonló áttörést jelent a biológiában, mint amit a Hubble-űrtávcső hozott a csillagászatban.