Mindannyian találkoztunk már kalcittal, még ha nem is tudtunk róla: a reggelihez feltört tojás héja, a tengerparton lábunkba szúródó süntüske vagy a vízkő legtöbbször ez az ásvány.
Ásványtani alapadatok
A kalcit a Mohs-féle keménységi skála harmadik tagja: Mohs-keménysége 3, vagyis körömmel már nem, de tűvel könnyen karcolható. A kalcit gyakori ásvány, többnyire színtelen vagy fehér, máskor halványsárga, de vörös és akár fekete is lehet. A víztiszta, színtelen kalcitváltozat a leghíresebb lelőhely után "izlandi pát" néven ismert.
Szilárd ionos vegyület, amely Ca2+ (kalcium) kationokból és CO32- (karbonát) összetett anionokból épül fel.
A kalcit a háromszöges (trigonális) kristályrendszerben kristályosodik, formagazdag ásvány, kristályai lehetnek lemezek, torzult kockára emlékeztető romboéderek, vagy akár tű alakúak is. A kalcit hasadása kitűnő: három egyenrangú hasadási iránya van, ezek nem derékszöget zárnak be egymással, így a hasadási idom nem kocka, hanem paralelepipedon lesz.
A kalcit változatos körülmények között képződhet: forró- és hidegvizes oldatokból, édes- vagy sós vízből egyaránt kristályosodhat. Éppen ezért jelen van hétköznapjainkban is: a meleg vizet használó berendezéseken (vízforraló, mosógép, zuhanyrózsa) kiváló vízkő fő alkotója. A vízkő ellen az ecetet hívhatjuk segítségül, ugyanis a kalcit már gyenge savas közegben is oldódik. Az oldódás során szén-dioxid gáz (CO2) keletkezik, amit buborékok fejlődése jelez.
Nézzen kalcitkristályokat galériánkban!
Mész, mészkő, égetett mész, oltott mész
A mész kifejezés a latin calx szóból származik, és különböző Ca-vegyületeket értettek/értenek alatta.
A mészkő főként kalcitból (trigonális kristályrendszerű CaCO3) álló kőzet. Az apróra tört mészkőből égetéssel (kalcinálással) nyerik az égetett meszet (kalcium-oxid, CaO; a folyamat: CaCO3 + hő => CaO + CO2). Ha az égetett mészhez vizet keverünk, heves reakció közben oltott mész, vagyis kalcium-hidroxid (Ca(OH)2) keletkezik. Az oltott mész lassan felveszi a levegőből a szén-dioxidot és újra kalcit keletkezik (Ca(OH)2 + CO2 => CaCO3 +H2O). Régen a habarcs mindössze homok, (oltott) mész és víz keveréke volt, és az építkezésnél a ragasztó szerep éppen a kalcit kristályosodásából adódott. Középkori váraink, templomaink köveit ma is e kalcit fogja össze.
CaCO3 - az élővilág is "mészből" építkezik
A Ca2+ a tengervíznek harmadik, az édesvíznek sok esetben leggyakoribb kationja. A levegő széndioxid-tartalma szénsavként (H2CO3) oldódik a vízben, amiből azután hidrogén-karbonát anion (HCO3-) ill. karbonát anion (CO32-) képződhet:
CO2 (gáz) + H2O <=> H2CO3 <=> HCO3- + H+ <=> CO32- + 2H+
Mind az édesvízben, mind a sós tengervízben adottak tehát CaCO3 alkotói (Ca2+ kation és CO32- összetett anion), ezért a CaCO3 könnyen kiválik/kiválasztható vizes oldatból. Éppen ezért sok élőlény külső vagy belső szilárd váza is "mészből" van, CaCO3 anyagú.
A CaCO3 kémiai összetétel többféle kristályszerkezettel párosulhat: a kalcit, az aragonit és a vaterit is CaCO3 összetételű ásványok. Ezt a jelenséget egy szilárd vegyület többalakúságának (polimorfia) nevezzük. Az élővilágban a kalcit- és az aragonitváz a gyakori (az aragonitot sorozatunk egy későbbi részében mutatjuk be).
Az élőlények által kiválasztott vázon nem látható a kristályok alakja, nem állapíthatjuk meg szabad szemmel, hogy trigonális rendszerű kalcitról vagy rombos kristályrendszerű aragonitról van-e szó. Ilyenkor a (talknál már bemutatott) röntgen-pordiffrakciót hívhatjuk segítségül: a tojás-, kagylóhéj vagy éppen éti csiga házának egy darabját porrá törjük, és a röntgensugárzás segítségével informálódunk kristályszerkezetéről. A leghétköznapibb példa kalcitra a tyúktojás héja, egyes kagylók vagy a tengeri sünök váza és tüskéi. A tengeri élőlények vázának anyaga sokszor függ a tengervíz hőmérsékletétől: meleg, trópusi vizekben inkább az aragonitváz a jellemző (pl. korallok), hideg vízben a kalcit. A szárazföldön az éti csiga aragonitból építi a házát.
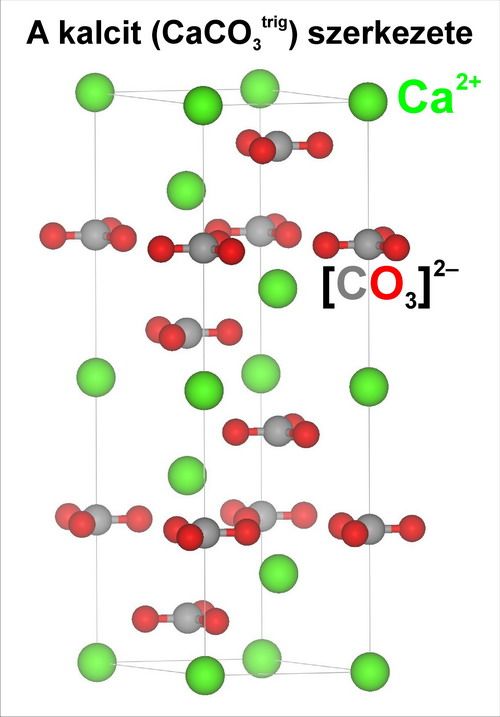
A kalcit szerkezete. A szürkével jelölt szénatomot háromszög alakban veszik körül a pirossal jelölt oxigénatomok. A szerkezetben a [CO3]2- karbonát anionok és a Ca2+ kalcium kationok (zöld) felváltva vízszintes síkokba rendeződnek

Felismerhetetlen lett Tom Cruise barátnője, a Top Gun szőke bombázója

Nagy Feró megrázó interjúban állt ki Orbán Viktor mellett

Megszólalt a bűvész, aki egy tízmilliós autót nyert a Zsákbamacska adásában

Elszólta magát az ATV-ben Rangos Katalin: Magyar vagy Márki-Zay Péterről beszélt? (VIDEÓ)

Pénzeső májusban, ez a 4 csillagjegy már nyithatja a pénztárcáját

Ő a Liverpool legönzőbb játékosa a klub legendája szerint

Ennyiszer hibázott eddig 2024-ben Joe Biden

Férfi kézi BL: a Kielce megóvta a Magdeburg elleni visszavágót

Hatalmas öröm Liverpoolban: megtörtént, amire Szoboszlai Dominikék az egész szezonban vártak

Mindenki ezen a lengyel falun ámul - képek

Félelmetes katonai szövetség jött létre a NATO ellen
