A kémia gyönyörű - csodálatos reakciók kínai kémikusok vegykonyhájából


Most pedig térjünk rá a részletekre.

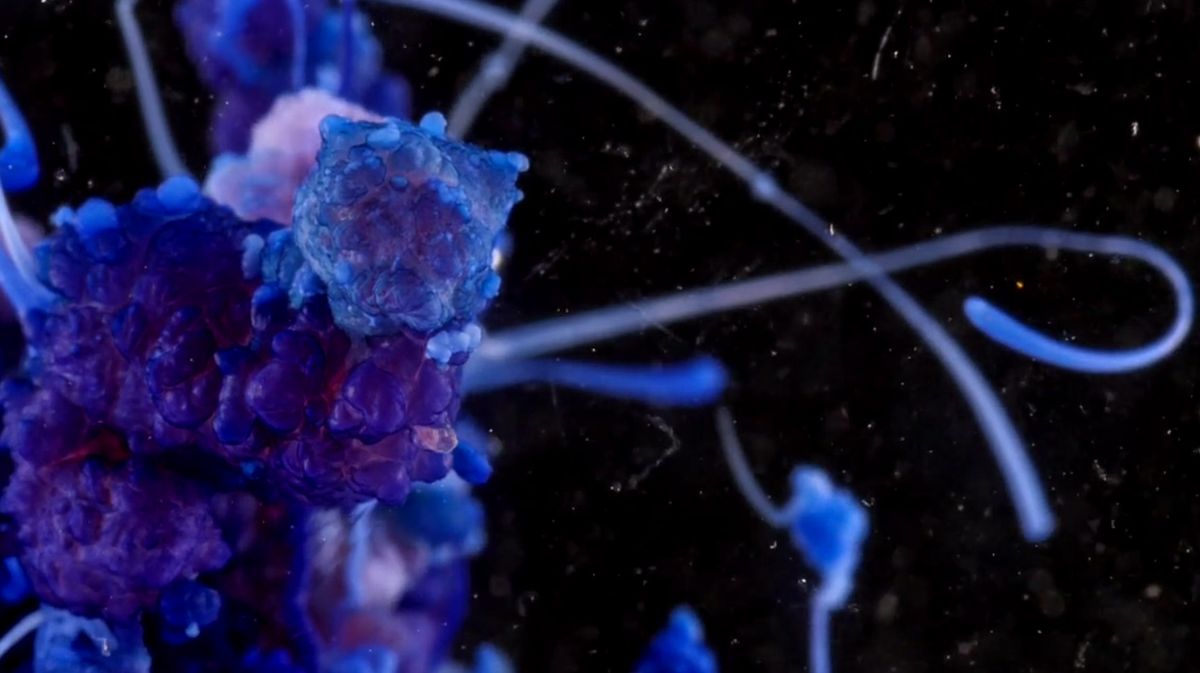
A cink igen reaktív fém, ezért is használják korrózióvédelemre. Ha más, nála kevésbé reaktív fémek vegyületeinek oldatába helyezik, ionjaik helyet cserélnek, és a másik fém válik ki. Ez a reakció csodásan működik ezüsttel, rézel és ólommal – utóbbi esetben a videót készítő vegyészek némi ecetsav és vízüveg segítségével gélbe fagyasztották az ólomfácskákat (ezért függenek a térben mozdulatlanul a buborékok).

Itt olyan reakciókat láthatunk, melyek során a vízben oldott vegyületekből szilárd anyag, vagyis csapadék keletkezik. Az első reakcióval úgy hihetnénk, hogy kijavíthatjuk elsózott levesünket, azonban a kicsapódott ezüst-kloridból hamar fémezüst válna ki a nyelvünkre, így hát inkább ne ezt a módszert válasszuk, ha szerelmes volt a szakács.
A második reakcióban ezüst-tioszulfát képződik, mely végül ezüst-szulfiddá alakul – ugyanarról az anyagról van szó, mely ezüstékszereink feketedését okozza, ha botor módon kénes gyógyvízben áztatjuk magunkat és őket. Ha vízben igazán oldhatatlan csapadékot keresünk, a következő reakcióban keletkező bárium-szulfátra bizton számíthatunk, ugyanis annyira leköti az egyébként mérgező báriumionokat, hogy biztonsággal használható a belekben CT-kontrasztanyagként. Az utolsó két reakcióban keletkező csapadék inkább szép, mint ismert, noha a kémikusok azért megtalálták a módját, hogy használják őket.
Ezekben a reakciókban a nátrium-szilikát vizes oldata, vagy közismert nevén vízüveg játssza a főszerepet. Amikor fémsókristályt helyezünk az oldatba, a kristály körül egy féligáteresztő szilikáthártya keletkezik, amely a vizet átengedi, de más ionokat nem. A megnövekvő nyomás miatt ez a hártya egy ponton kilukad, itt kiáramlik a fémsó oldata, újabb szilikáthártyát hoz létre maga körül, és már növekszik is a kertecskénk.

Ezeken a felvételeken négy vegyület kristályosodását figyelhetjük meg, ahogy kiválnak telített oldataikból. A kristályok mindegyike tartalmaz a szerkezetébe ágyazott, pontosan meghatározott mennyiségű úgynevezett kristályvizet.
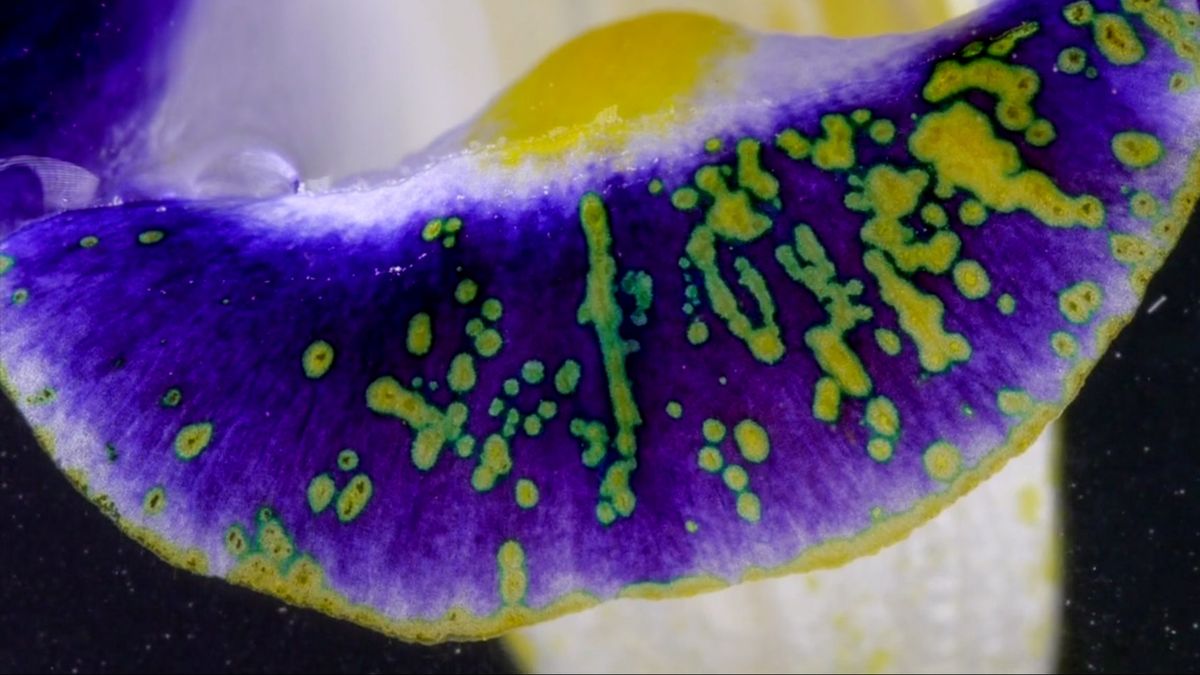
Egyes növényi színanyagok változtatják színüket attól függően, hogy savas vagy lúgos kémhatás éri őket. Megfigyelhetjük, hogyan változik meg a lilakáposzta, valamint egy Torenia fournieri nevű növény virágának színe, ha nátronlúggal vagy sósavval locsolgatjuk.

Ez a folyamat bizonyos értelemben rokon a csapadékképződéssel, hiszen a reakciótermék itt is távozik az oldatból – igaz, ezúttal felfelé, gáz formájában. Vájt fülűek számára különösen érdekes lehet az utolsó kísérlet, melyben nátronlúgoldat elektromos bontását (elektrolízisét) láthatjuk. A papírra írt reakcióegyenlet itt látványosan elevenedik meg, hiszen megfigyelhetjük, hogy a katódon valóban kétszer annyi gáz keletkezik, mint az anódon.
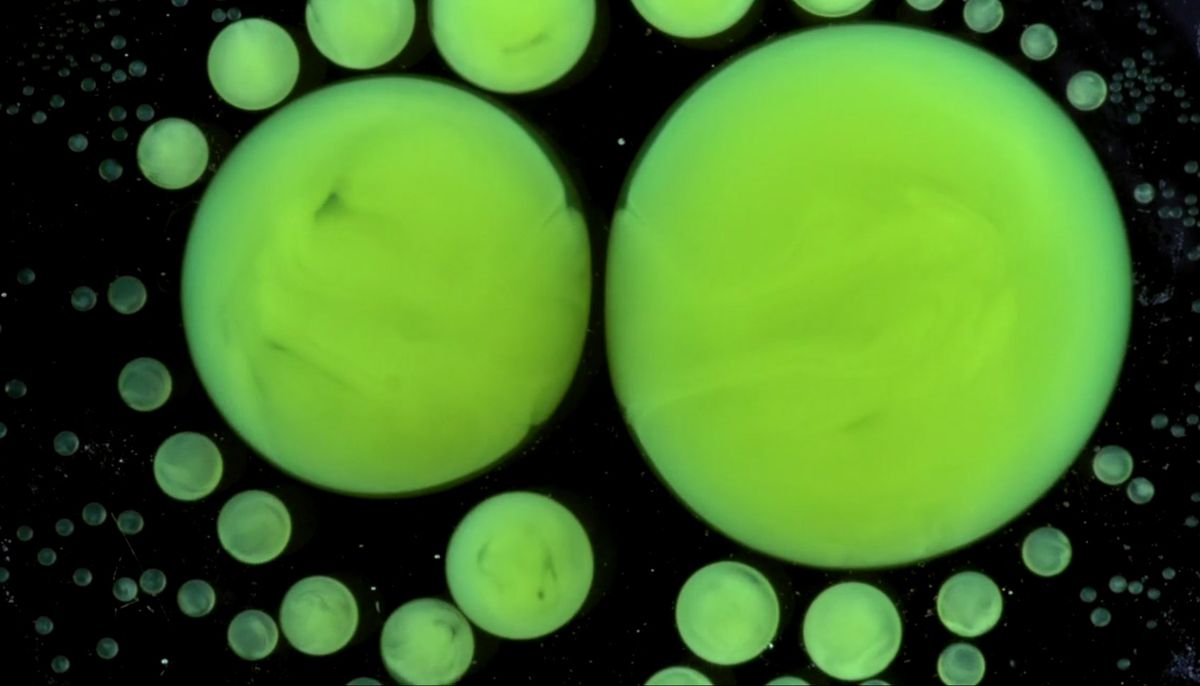
A játékos kedvű kísérletezők itt már leginkább a látványra mentek. A fluoreszkáló bulipálcák (bármi is legyen a nevük) olajos folyadékát nátronlúggal keverték össze, és így csöpögtették vízbe. A buborékok táncát valószínűleg az okozza, hogy az olajcseppek nátrium-hidroxid-tartalma vizet próbál beszívni a környezetből, ugyanakkor a buborékok a felületi feszültség miatt tartani akarják az alakjukat.

Az első két reakció mindenki számára ismert lehet, a harmadik szorul csak némi magyarázatra. Itt a kísérletező kedvű vegyészek egy tömény sósavcseppet lógattak ammóniagázba. A kiváló fehér füst (és a cseppen megjelenő csapadék) nem más, mint a két vegyület sója, az ammónium-klorid.
Ha immár más színben látja a kémiát, és többre vágyik, könnyfacsaró történetekért, csöpögős részletekért és színes kis hírekért látogasson el a Beautiful Chemistry oldalára.











